对于无驱动突变的晚期肺小细胞肺癌患者,化疗±免疫检查点抑制剂是标准治疗,但进展后,患者二线治疗并不令人满意,ORR仅为6%~20%,中位PFS仅为2~4个月。25%~30%的非鳞、非小细胞肺癌患者携带KRAS驱动基因突变,该突变定义了一类不同且极具临床异质性的晚期非小细胞肺癌患者。目前的标准治疗仅能给患者提供轻微获益。在所有KRAS突变类型中,KRAS G12C突变占比约为13%。发生该突变的患者可将KRAS蛋白锁定在激活状态,使得下游细胞信号转导通路持续活化,并导致细胞的增殖。AMG-510是一款针对KRAS G12C突变的小分子化合物,I期CodeBreaK100研究发现,该化合物针对携带KRAS G12C突变的晚期非小细胞肺癌患者显示了良好的安全性以及疗效。本研究旨在通过扩大样本含量,进一步确认该药物的疗效及安全性。
这是一项多中心、单臂、开放标签的II期临床研究,旨在探索AMG-510 后线治疗携带KRAS G12C突变的晚期非小细胞肺癌患者的疗效及安全性。研究纳入组织病理学或细胞病理学确认的年龄≥18周岁的患者,无论患者PD-L1表达水平均允许入组。既往治疗线数不得大于3线。有脑转移的患者不允许入组。符合入组标准的患者给予960mg,口服,每日一次的AMG-510治疗。该研究主要终点为ORR,次要研究终点包括DCR、PFS、OS及安全性。探索性研究分析了PD-L1表达水平、TMB等不同标志物和疗效之间的关系。
从2019年8月至2020年2月,共计126例患者纳入研究,其中2例患者基线无可测量数据,1例患者没有中心实验室确认的G12C突变。数据截止时间为2020年3月,中位随访时间为15.3个月,患者既往中位治疗线数为两线,分别有89.7%和92.1%的患者既往接受过铂类药物治疗及免疫检查点抑制剂治疗,81%的患者接受过两者治疗 19.8%的患者接受过抗血管生成治疗(图1)。
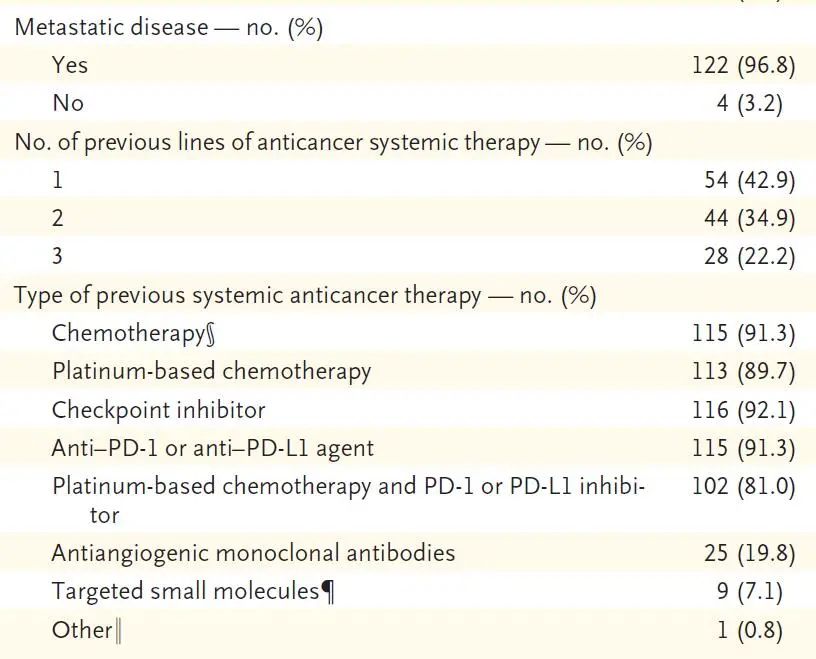
图1 患者的部分基线数据
疗效:124例患者的 ORR为37.1%,其中CR比例为3.2%,PR比例为33.9%,DCR为80.6%,中位至响应出现时间为1.4个月,响应持续时间为11.1个月,3个月、6个月、9个月的响应持续率分别为90.5%、70.8%和57.3%(图2)。

图2 患者的ORR
中位PFS为6.8个月,6个月和9个月的PFS率分别为52.2%和37.5%。

图3 患者的中位PFS
患者中位OS为12.5个月。

图4 患者的中位OS
探索性研究分析了PD-L1表达水平、TMB水平、STK11、KEAP1及TP53共突变对疗效的影响。86例患者有PD-L1表达数据,其中,PD-L1表达小于1%和全组人群的ORR分别为48%和42%。84例患者具有可评估的TMB数据,TMB低表达和全组人群的ORR分别为42%和40%,合并STK11突变,但KEAP1野生型的患者和全组患者的ORR分别为50%和39%。KEAP1突变的患者及全组患者ORR分别为23%和14%。

图5 不同特点患者的亚组分析
安全性:全组有99.2%的患者出现全因、任何级别不良反应,其中3度、4度、5度不良反应发生率分别为42.1%、3.2%和15.9%,69.8%的不良反应考虑和治疗相关,治疗相关的3度、4度不良反应发生率分别为19.8%和0.8%,没有治疗相关的5级不良事件出现,22.2%的患者因不良反应导致治疗中断,7.1%的患者永久性终止治疗(图6)。

图6 患者的部分安全性数据
AMG-510后线治疗携带KRAS G12C突变的晚期非小细胞肺癌患者,可带来持久的临床获益,没有新的安全性事件出现。
尽管KRAS突变是第一个在实体瘤中被发现的驱动突变,但由于该靶点的极端难以成药性,因此,近40年来针对该靶点临床上难以有突破性的治疗手段,因此,这部分患者一直被当做驱动突变阴性的患者来进行对待。接下来,笔者将对KRAS突变进行系统总结。
KRAS基因定位于第 12 号染色体的短臂上,其编码的蛋白是一种小GTP酶,有188个氨基酸,并最终锚定于细胞膜的内侧。KRAS编码的蛋白有激活和失活两种状态,当KRAS与鸟嘌呤核苷二磷酸(GDP)结合时,它处于失活状态,当它与鸟嘌呤核苷三磷酸(GTP)结合时,它处于激活状态,并且可以激活下游信号通路,这些通路包括MAPK信号通路,PI3K信号通路等,而这些信号通路在促进细胞生存、增殖和细胞因子释放方面具有重要作用。KRAS在失活与激活状态之间的转换受到两类因子的调节,其一是鸟嘌呤核苷酸交换因子,这类蛋白催化KRAS与GTP的结合,从而激活KRAS蛋白;其二是GTP酶(GTPase)激活蛋白(GAPs),这类蛋白能够使得GTP水解成为GDP,从而抑制KRAS的活性。当KRAS基因发生突变后,会干扰及降解GTP的能力,从而使KRAS蛋白持续处于激活状态。
在NSCLC患者中,15%左右的患者携带KRAS基因突变,尤其以第12及13外显子的突变最为常见,包括G12C、G12V、G12S、G12D及G13D等突变。
KRAS突变的不可成药性主要有两方面的原因,首先是KRAS蛋白的独特结构。通常情况下,小分子化合物都是通过共价结合的方式与相关蛋白结合进而抑制其功能,而这个过程中,小分子药物需要与ATP或者GTP竞争性的和相关位点结合,因此,药物对靶点的阻断是否彻底一方面受药物的浓度影响,另一方面受靶点蛋白和ATP/GTP的亲和力影响。一般情况下,蛋白激酶与ATP的亲和力较弱, 而KRAS与GTP或GDP的结合非常强,亲合系数达到皮摩尔级别(10-12级),而正常细胞里面的GDP与GTP的浓度达到了微摩尔级(10-6级),而增加药物浓度可能大大增加不良反应;其次,KRAS蛋白的结构类似于圆形,缺乏足够大的能够结合小分子的口袋,使得药物难以与蛋白进行结合。
这两方面综合原因,使得KRAS突变近40年来难以有突破性的治疗药物。
早在2020年9月,AMG-510治疗KRAS G12C突变的实体瘤患者的相关研究就已经发表于《新英格兰医学杂志》,在这项多队列研究中,AMG-510治疗KRAS G12C突变的非小细胞肺癌患者显示了良好的疗效及安全性。59例NSCLC患者中,ORR达到32.2%,DCR达到88.1%,中位PFS为6.3个月,和本次公布的II期临床研究数据基本一致。目前,该药已经被FDA批准上市,后线治疗携带KRAS G12C突变的晚期NSCLC患者。
除AMG-510外,另一款极具前景的治疗药物是MRTX849 (Adagrasib),其初步的数据已经于今年欧洲肺癌大会公布。结果显示,该药后线治疗携带KRAS G12C突变的晚期NSCLC患者,ORR为45%,DCR为96%,中位缓解持续时间9.2个月。除了这两款药物外,目前还有多款相关的化合物正在研发中。

部分在研的针对KRAS G12C突变的药物
近期,《肿瘤学年鉴》在线发表了针对KRAS突变的相关综述性文章。在文章中,作者对KRAS的过去及未来的发展进行了展望。首先就是耐药机制问题。关于KRAS的耐药机制,近期发表于JTO杂志的一项研究率先在体外进行了探索。与其他靶向治疗一样,二次突变仍然是主要的耐药机制,其中包括Y96D及Y96S等突变。同时,这部分药物能否在一线治疗拥有一席之地?是单药还是联合治疗?目前尚需要更多循证医学证据的支持。

发表于JTO杂志的耐药机制研究
针对KRAS G12C突变的靶向药物已经在临床落地,但是需要注意的是,从目前的数据来看,其中位PFS仅有6个月左右,在数值上和化疗持平,与一代EGFR-TKI或者ALK-TKI尚无法比肩,和三代EGFR-TKI或ALK-TKI更是差距甚大;同时针对其他的突变类型,如KRAS G12V或KRAS G12D等突变,目前也尚无有效的治疗手段。





 京公网安备 11010502033352号
京公网安备 11010502033352号